III – SOLUÇÕES
III.1 – Classificação das Misturas: Soluções e Dispersões.
Frequentemente as substâncias químicas (elementos e
compostos) encontram-se misturadas umas às outras. O
sangue, a água do mar, o solo e o próprio ar são exemplos de
misturas. As misturas podem ser heterogêneas ou
homogêneas.
microscópio mais potente. As propriedades
organolépticas e algumas propriedades físicas são
heterogêneas são também chamadas de
As dispersões são formadas por um constituinte em maior
quantidade de matéria chamado de DISPERGENTE e um ou
mais constituintes em menor quantidade de matéria chamados
de DISPERSOS.
As dispersões podem ser classificadas, quanto ao
tamanho das partículas do disperso, em dispersões grosseiras
(diâmetro das partículas superior a 1000 Å) e dispersões
coloidais (diâmetro de partículas entre10 e 1000 Å).
1 Å = 10-10 m
b) Misturas homogêneas: são misturas que apresentam
uma única fase, são também chamadas de
SOLUÇÕES. As soluções são formadas por partículas
que apresentam diâmetros inferiores a 10 Å.
em maior quantidade de matéria chamada de SOLVENTE e um
A figura abaixo resume a classificação das misturas quanto
aos tamanhos das partículas que as formam:
III.2 –Classificação das soluções
a) Classificação quanto às fases de agregação: As
soluções podem ser sólidas, líquidas ou gasosas. A
fase de agregação do solvente é quem determina a
fase de agregação da solução.
Soluções sólidas: latão, bronze, ouro, aço;
Soluções líquidas: água do mar, gasolina, soro
fisiológico;
Soluções gasosas: ar, gás de cozinha;
b) Classificação quanto à condução da corrente
eletrolíticas e eletrolíticas.
b.1). Soluções não eletrolíticas: são também chamadas
de soluções moleculares, pois as partículas do
soluto são moléculas neutras. Essas soluções não
conduzem corrente elétrica.
Exemplo: solução de sacarose em água,
solução de etanol em água.
b.2). Soluções eletrolíticas: são também chamadas de
soluções iônicas, nessas soluções as partículas do
elétrica.
Exemplo: cloreto de sódio em água, solução
de hidróxido de sódio e sulfato de sódio.
+ −
+ −
+ −
⎯⎯⎯→ +
⎯⎯⎯→ +
⎯⎯⎯→ +
2
2 4 4 2 2
2
2
Na SO Na SO
NaOH Na OH
HCl H Cl
H O
H O
H O
c) Classificação quanto à concentração do soluto na
solução: As soluções podem ser classificadas em
diluídas e concentradas.
diluída quando a concentração do soluto é
considerada pequena. Porém, não existe um
parâmetro rigoroso para estabelecer se uma
solução é diluída. Admite-se, geralmente, que
soluções de concentração até 0,1 mol/L são
diluídas.
concentração do soluto é considerada elevada,
geralmente, superior a 0,1 mol/L.
quantidade padrão de solução ou de solvente.
Dependendo das grandezas utilizadas para expressar as
quantidades de soluto e de solvente teremos diferentes
expressões de concentração. Essas expressões de
concentração podem ser físicas ou químicas.
III.3.1 –Expressões físicas de concentração
As expressões físicas de concentração são aquelas que
não dependem da massa molar do soluto.
a) Título em massa (τ): o titulo em massa indica o número
de unidades de massa de soluto existente em 100
unidades de massa da solução.
O título em massa pode ser igualmente expresso em
termos percentuais, nesse caso, é denominado de
porcentagem em massa do soluto.
Uma solução de KCl 10% possui 10 g de soluto em
100 g de solução ou 90 g de água.
100 g de solução ou 70 g de água.
Exemplo: Uma massa de 40g de NaOH são dissolvidas em
160g de água. Qual a porcentagem, em massa, de NaOH
presente nesta solução?
b) Título em volume (τV): o titulo em volume indica o
número de unidades de volume de soluto existente em
O título em volume pode ser igualmente expresso em
termos percentuais, nesse caso, é denominado de porcentagem em volume do soluto.
Exemplo: Calcule a porcentagem em volume de etanol em uma
solução preparada pela dissolução de 80 g de etanol em 1L de
água destilada. Considere a densidade do etanol como sendo
igual a 0,8 g/mL e a densidade da solução resultante como
sendo igual a 0,998 g/mL.
indica a massa de soluto (msoluto) que se encontra
dissolvida em um volume padrão de solução (Vsolução).
Geralmente a concentração do soluto é expressa em g/L,
porém, pode ser expressa eventualmente em g/mL, kg/L,
mg/dL, etc.
Exemplo: 40 g de nitrato de potássio foram dissolvidos em 190
cm3 de água destilada, fornecendo 200 cm3
de solução. Calcule
a concentração em massa dessa solução em g/L.
Exemplo: Num balão volumétrico de 250 mL adicionou-se 2 g
de sulfato de amônio [(NH4)2SO4]. Qual a concentração da
solução obtida, em g/L.
d) Concentração em partes por milhão (ppm): a
concentração em partes por milhão indica quantas partes
do soluto existem em um milhão de partes da solução (em
1 ppm= 1 parte do soluto / 106
partes de solução
Concentração em ppm expressa em volume/volume –
ppm(v/v): unidade usada para expressar concentrações de
soluções gasosas.
1 ppm (v/v) = 1 cm3
de soluto / 1 m3
de solução
Concentração em ppm expressa em massa/massa –
ppm(m/m): unidade usada para expressar concentrações de
misturas sólidas.
çã
Concentração em ppm expressa em massa/volume –
ppm(m/v): unidade usada para expressar concentrações de
soluções muito diluídas.
1 ppm (m/v) = 1 mg de soluto / 1 L de solução
Exemplo: Quantos gramas de cloreto existem em 1000 L de
250 ppm (m/v).
e) Concentração em partes por bilhão (ppb): a
concentração em partes por bilhão indica quantas partes
do soluto existem em um bilhão de partes da solução (em
volume ou em massa)
1 ppb= 1 parte do soluto / 109
partes de solução
entre a massa e o volume dessa solução.
A densidade de uma solução varia de acordo com a
quantidade de soluto dissolvida em uma dada quantidade
padrão de solução. Assim, a densidade pode ser usada como
uma unidade de concentração. Geralmente, se expressa à
densidade em g/mL, porém outras unidades podem ser
usadas.
Através da densidade podemos relacionar o título e a
concentração em massa de uma solução:
C(g/L) = 1000 (mL/L) x d (g/mL) x τ
Exemplo: Misturando-se 30 mL de etanol e 70 mL de água
obtém-se uma solução de densidade igual a 0,97 g/mL a 20°C,
sabendo que a densidade do etanol é 0,8 g/mL calcule a
porcentagem em massa de etanol na solução e a sua
concentração em g/L.
III.3.2 – Expressões químicas de concentração
As expressões químicas de concentração são aquelas que
dependem da massa molar (MM) do soluto.
Neste ponto devemos lembrar que a massa molar de uma
substância expressa à massa em gramas de um mol dessa
substância.
A quantidade de matéria (n) pode ser calculada dividindose
a massa de uma substância por sua massa molar:
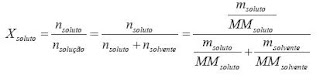
a) Fração em quantidade de matéria (X): a fração em
quantidade de matéria de um soluto em uma solução é a
razão entre a quantidade de matéria do soluto e a
quantidade total de matéria da solução.
Analogamente, temos:
EXEMPLO: Calcular as frações em quantidade de matéria do
soluto e do solvente em uma solução preparada a partir da
mistura de 80 g de metanol (CH3OH→ 32 g/mol) e 720 g de
água (H2O→ 18 g/mol).
b) Concentração em quantidade de matéria (M): é a
razão entre a quantidade de matéria de um soluto e o
volume da solução em litros.
A concentração em quantidade de matéria é a unidade de
concentração recomendada pela IUPAC. Informalmente é
chamada de molaridade.
EXEMPLO: Calcule quantos gramas de hidróxido de sódio
(NaOH→ 40 g/mol) são necessários para preparar 500 mL de
uma solução 0,8 mol/L desta substância.
c) Molalidade (w): unidade de concentração química que
expressa a quantidade de matéria dissolvida numa
massa de 1 quilograma de solvente.
A molalidade é útil quando grande rigor é exigido na
medida da concentração e trabalha-se em condições não
isotérmicas.
EXEMPLO: Calcule a molalidade de uma solução de glicose
(C6H12O6 → 180 g/mol), preparada pela dissolução de 45 g de
glicose em 1,0 L de água.
d) Normalidade (N): a normalidade é a relação entre o
número de equivalente-grama do soluto (ne) e o volume
da solução em litros (V).
O equivalente-grama (E) de uma substância equivale
à massa em gramas dessa substância que reage
movimentando 1,0 mol de elétrons.
Desta forma o equivalente-grama de uma substância
dependerá da reação da qual ela participe. Uma
substância pode assim ter mais de um equivalentegrama.
No cálculo teórico do equivalente-grama (E) dividimos a
massa molar da substância (MM) pela valência (k) da mesma.
O valor de k é determinado de forma diferente segundo o
tipo de substância em questão:
Ácidos → k é igual ao número de hidrogênios ionizáveis;
Hidróxidos → k equivale ao número de hidroxilas;
Sais → k equivale à carga total dos cátions ou dos ânions
tomada em módulo;
Oxidantes e redutores → k equivale ao número de elétrons
trocados durante a reação de oxidação ou redução.
EXEMPLO: Calcule o equivalente-grama das seguintes
substâncias: ácido sulfúrico (98 g/mol), ácido fosfórico (98
g/mol), ácido fosforoso (82 g/mol), hidróxido de cálcio (74
g/mol), sulfato de alumínio (342 g/mo), dicromato de potássio
(294 g/mol) (6e-+ H2S + Cr2O7
2- → 2Cr3++ 7H2O).
O número de equivalente-grama (ne) contidos em uma
massa qualquer de substância é calculado como a razão entre
a massa da substância e o seu equivalente-grama:
Dividindo o número de equivalente-grama do soluto pelo
volume da solução em litros obtemos a normalidade de uma
solução:
EXEMPLO 01: Calcule a normalidade de uma solução de ácido
sulfúrico obtida pela dissolução de 4,9 g desse ácido em 500
mL de solução.
Exemplo 02: O hidróxido de amônio P.A. é vendido sob a forma
de uma solução contendo entre 28 e 30% de NH4OH (35
g/mol), cuja densidade é igual a 0,91 g/mL. Calcule quantos
mililitros de hidróxido de amônio P.A devem ser utilizados para
preparar 500 mL de uma solução 0,4 eq/L.
III.3.3 – Convertendo unidades químicas de concentração
a) Convertendo concentração em quantidade de matéria
em concentração em massa: para convertermos a
molaridade (concentração em quantidade de matéria) em
concentração em massa, devemos multiplicar a
molaridade pelo valor da massa molar do soluto.
EXEMPLO 01: Qual é a concentração em g/L de uma solução
de cloreto de sódio (NaCl → 58,5 g/mol) 0,1 mol/L?
EXEMPLO 02: Qual é a molaridade de uma solução que
contém 6,3 g/L de ácido nítrico (HNO3 →63 g/mol)?
b) Convertendo concentração em quantidade de matéria
em molalidade: para convertermos a concentração em
quantidade de matéria em molalidade é necessário que a
densidade da solução seja conhecida. Os passos a seguir
possibilitam a conversão de molaridade em molalidade:
1) Achar a massa correspondente a 1,0 L de solução
usando a densidade.
2) Subtrair a massa de soluto contida em 1,0 L de solução
da massa da solução para achar a massa de solvente.
3) Aplicar a definição de molalidade, lembrando de
transformar a massa de solvente em kg.
EXEMPLO: Calcule a molalidade de uma solução de glicose,
C6H12O6 (180 g/mol), cuja concentração em quantidade de
matéria é 0,5 mol/L e cuja densidade é 1,014 g/mL.
c) Convertendo concentração em quantidade de matéria
em normalidade: para convertermos a molaridade
(concentração em quantidade de matéria) em
normalidade, devemos multiplicar a molaridade pelo valor
da valência do soluto.
N = k . M
EXEMPLO: Qual é a normalidade de uma solução de ácido
sulfúrico 0,5 mol/L?
d) Convertendo normalidade em concentração em
massa: para convertermos a normalidade em
concentração em massa devemos multiplicar o valor em
normalidade pelo equivalente-grama do soluto.
III.4 –Diluição de soluções
DILUIÇÃO: processo no qual se adiciona solvente a uma
solução de forma a diminuir sua concentração.
Obs. 1: O processo inverso à diluição é a concentração.
Na operação de concentração retira-se solvente da solução,
geralmente por evaporação, aumentando-se a concentração da
mesma.
Obs. 2: Nos processos de diluição e concentração alterase
o volume de solução, porém, a quantidade de soluto (em
massa, quantidade de matéria ou número de equivalentes)
permanece inalterado.
ESQUEMA GERAL DE UMA DILUIÇÃO:
Quando uma diluição é realizada, podemos escrever a
seguinte relação entre as concentrações da solução inicial e da
solução final (resultante da diluição).
Onde: Ci e Cf podem ser expressas em concentração em
massa, concentração e quantidade de matéria ou normalidade.
EXEMPLO: 20 mL de uma solução de concentração igual a 8
g/L de hidróxido de potássio foram diluídos até um volume final
de 100 mL. Calcule a concentração em mol/L da solução
resultante.
III.5 –Mistura de soluções
III.5.1 –Mistura de soluções de mesmo soluto
Quando duas soluções de um mesmo soluto e mesmo
solvente, porém, de concentrações diferentes, são misturadas,
obtemos uma solução de concentração intermediária entre as
duas soluções misturadas.
A quantidade de soluto presente na solução resultante
será igual à soma das quantidades de soluto existentes nas
soluções originais.
ESQUEMA GERAL DE UMA MISTURA DE SOLUÇÕES:
A equação a seguir permite calcular a concentração da
solução resultante da mistura de duas soluções:
Teremos que a concentração da solução resultante será:
Onde, C1, C2 e C3 são concentrações expressas em g/L,
mol/L ou eq/L.
EXEMPLO: Calcule a concentração de uma solução de
sacarose obtida pela mistura de 200 mL de uma solução 0,2
mol/L de sacarose com 600 mL de outra solução 0,6 mol/L de
sacarose.
III.5.2 –Mistura de soluções de solutos diferentes sem
reação química
Na mistura de duas soluções de mesmo solvente,
contendo solutos diferentes que não reagem entre si, podemos
tratar cada soluto isoladamente como se ocorresse uma
diluição.
EXEMPLO 01: 500 mL de uma solução 0,4 mol/L de glicose
são misturados a 300 mL de uma solução 0,8 mol/L de frutose.
Calcule as concentrações de glicose e frutose na solução
resultante.
EXEMPLO 02: Quando 200 mL de uma solução 0,1 mol/L de
NaNO3 são misturados com 300 mL de uma solução 0,2 mol/L
de Ba(NO3)2, a concentração de íons nitrato na solução
resultante, expressa em mol/L, será igual a:
a) 0,03 b) 0,07 c) 0,14 d) 0,28
III.5.3 –Mistura de soluções de solutos diferentes com
reação química
Quando misturamos soluções de solutos diferentes que
reagem entre si, a concentração das espécies presentes na
solução resultante dependerá da quantidade de reagentes
consumidos e da quantidade de produtos formados na reação.
Devemos efetuar, então, um balanço de matéria, considerando
as quantidades de matéria inicialmente presentes, quanto foi
consumido e quanto foi gerado de cada espécie pela reação.
REAGENTE LIMITANTE: Num dado sistema reacional chamase
de reagente limitante aquele que se encontra em quantidade
inferior à necessária para reagir estequiometricamente com os
outros reagentes que participam da reação. O reagente
limitante será completamente consumido na reação.
REAGENTE EM EXCESSO: Reagente que não é consumido
inteiramente na reação por encontrar-se em quantidade
superior à necessária para reagir estequiometricamente com os
outros reagentes que participam da reação.
EXEMPLO: 200 mL de uma solução 0,5 mol/L de ácido
sulfúrico foram adicionados a 800 mL de uma solução 0,4
mol/L de NaOH. Calcule as concentrações em quantidade de
matéria de NaOH, H2SO4 e Na2SO4 na solução resultante.


























Nenhum comentário:
Postar um comentário